Většinou si vůbec neuvědomujeme, v nakolik smrtelně nebezpečném prostředí žijeme. Neustále vdechujeme a pojídáme miliardy potenciálně smrtelně nebezpečných bakterií, virů a kvasinek, před nimiž nás většinou úspěšně chrání imunitní systém. Ten disponuje arzenálem mocných zbraní, které zabraňují, aby tyto mikroorganismy pronikly do našeho těla a nekontrolovaně se tam množily jako v organismech mrtvých, v nichž tento obranný systém již nefunguje.
Zdaleka to nejsou jen běžně známé protilátky, ale i nejméně 20 druhů buněk zvaných leukocyty,„bílé buňky“, respektive bílé krvinky (nepřesný název, protože většina z nich se v krvi nevyskytuje), a více než tisíc druhů bílkovinných molekul, jež pomáhají mikrobiální vetřelce rozpozpoznat, neutralizovat a nakonec i zničit.
B-lymfocyty
První imunitní zbraně imunologové rozpoznali už koncem 19. století. Byly to za prvé buňky nazvané fagocyty, „žravé buňky“ – bílé krvinky pohlcující bakterie podobně, jako když se prvoci měňavky zmocňují částic potravy. Do stejné doby spadá i objev protilátek, bílkovinných (proteinových) molekul, které se navazují na struktury, jež jsou pro organismus cizorodé a potenciálně škodlivé.
Protilátky jsou sice známé již více než 120 let, ale až před téměř 60 lety byly objeveny buňky, které je produkují – nenápadné malé bílé krvinky zvané B-lymfocyty. Ty mají na svém povrchu zakotveno asi 50 tisíc protilátkových molekul, jejichž pomocí rozpoznávají struktury, které do organismu nepatří. |
Tyto molekuly mají tvar miniaturních písmen Y, která mají specifická vazebná místa na koncích obou „ručiček“. Když se takové protilátky naváží například na povrch bakterie, mohou jí tím znemožnit nasednutí na povrch infikované buňky. Takové protilátkami obalené bakterie jsou potom také mnohem lépe rozpoznávané a pohlcované žravými buňkami.
Protilátky jsou sice známé již více než 120 let, ale až před téměř 60 lety byly objeveny buňky, které je produkují – nenápadné malé bílé krvinky zvané B-lymfocyty. Ty mají na svém povrchu zakotveno asi 50 tisíc protilátkových molekul, jejichž pomocí rozpoznávají struktury, které do organismu nepatří. Když takové rozpoznání nastane, začne se příslušný B-lymfocyt rychle dělit a po několika dnech tisíce dceřiných buněk chrlí miliony rozpustných protilátkových molekul.
Přitom vznikají také paměťové B-lymfocyty, které po opakovaném setkání s obdobnými cizorodými strukturami (třeba po několika desítkách let) spustí rychle tvorbu protilátek. To je spolu s určitým množstvím dlouho přetrvávajících primárně vzniklých protilátek podstatou imunitní paměti, tedy toho, že pokud proděláme některé infekční choroby (nebo jsme proti nim očkováni), podruhé je nedostaneme.
Genetické mechanismy
Mimořádně zajímavý je mechanismus, že imunitní systém je schopný tvořit protilátky specificky rozeznávající v podstatě jakékoli látky. Tato záhada zaměstnávala za mých studentských dob přední světové imunology. Objevila se hypotéza, že buňky, které vyrábějí protilátky – B-lymfocyty – mají v buněčném jádře obrovskou spoustu genů, z nichž každý kóduje protilátku s trochu odlišným vazebným místem.
Genetické mechanismy, které se při vzniku takového obrovského vazebného repertoáru uplatňují, jsou založeny na kombinaci náhodného přeskupování několika genových úseků, nepřesností při spojování přeskupovaných úseků a intenzivních mutacích těchto zpřeházených genových úseků |
To se zdálo nemožné – potřebný počet genů by se do buňky nevešel, i kdyby byla tisíckrát větší! Nakonec se ale ukázalo, že to skutečně tak nějak je. Při vývoji B-lymfocytů v kostní dřeni totiž vznikají miliony klonů těchto buněk, které se liší detaily vazebných míst svých protilátek.
Genetické mechanismy, které se při vzniku takového obrovského vazebného repertoáru uplatňují, jsou založeny na kombinaci náhodného přeskupování několika genových úseků, nepřesností při spojování přeskupovaných úseků a intenzivních mutacích těchto zpřeházených genových úseků. Zralý imunitní systém je potom připraven prakticky na cokoli – ať se do organismu dostane v podstatě jakákoli cizorodá molekula, některé klony B-lymfocytů ji rozpoznají.
Deset tisíc druhů proteinů
Velikost vazebného repertoáru je taková, že naprostá většina klonů není v průběhu života nikdy použita. Tento systém se podobá velkému, až absurdně marnotratně přezásobenému konfekčnímu obchodu, ve kterém jakýkoli zákazník – obr, trpaslík, tlusťoch či anorektický hubeňour – najde po chvíli hledání oblek, který mu padne, a bude mít dokonce barvu a vzor, jenž se mu líbí.
DNA v jádře každé savčí buňky obsahuje okolo 21 tisíc genů, tedy úseků kódujících individuální bílkovinné (proteinové) molekuly. Z nich je kdykoli „zapnuta“ zhruba polovina, takže v buňce se neustále produkuje zhruba deset tisíc druhů proteinů. Některé se v buňce vyskytují jen v několika stovkách kopií, jiných jsou tisíce až miliony. |
Na tomto místě je třeba upozornit na něco, co si většinou vůbec neuvědomujeme – nakolik jsou buňky (všechny, nejen ty imunitní) neuvěřitelně složité. DNA v jádře každé savčí buňky obsahuje okolo 21 tisíc genů, tedy úseků kódujících individuální bílkovinné (proteinové) molekuly. Z nich je kdykoli „zapnuta“ zhruba polovina, takže v buňce se neustále produkuje zhruba deset tisíc druhů proteinů. Některé se v buňce vyskytují jen v několika stovkách kopií, jiných jsou tisíce až miliony.
Navíc buňky obsahují tisíce jiných druhů malých i velkých molekul. Tyto komponenty spolu specificky interagují, spolupracují, vytvářejí více či méně stabilní struktury, vyrábějí energii potřebnou pro život buňky, opotřebované a poškozené molekuly jsou rozkládány a většinou znovu využívány, a nahrazovány nově syntetizovanými molekulami. I ta nejjednodušší buňka, třeba bakteriální, je neskonale složitější, než co člověk umí vytvořit…
Ničení buněk
Ale zpět k imunologii. Protilátky jsou sice skvělé zbraně, ale neúčinné proti parazitům, kteří se před nimi schovají dovnitř buněk, především viry a některé bakterie. Proto se evoluce postarala o vznik další nepostradatelné imunitní zbraně – „zabíječské“ (cytotoxické) T-lymfocyty. Ty se specializují na rozpoznávání buněk infikovaných vnitrobuněčnými parazity a ničí je.
Evoluce se postarala o vznik další nepostradatelné imunitní zbraně – „zabíječské“ (cytotoxické) T-lymfocyty. Ty se specializují na rozpoznávání buněk infikovaných vnitrobuněčnými parazity a ničí je. |
To je trochu překvapivá strategie – člověk by čekal, že se imunitní systém bude spíše snažit infikované buňky vyléčit! Nicméně tato trochu riskantní vražedná strategie zajišťuje, aby se infikované buňky nemohly stát zdrojem šíření infekce. Podobně umějí tyto T-lymfocyty zabíjet i některé nádorové buňky.
Dlouho nebylo jasné, jak tito zabijáci rozpoznají infikované buňky od zdravých. Až koncem osmdesátých let byl odhalen překvapivý mechanismus založený na MHC proteinech, které jsou na povrchu téměř všech našich buněk. U lidí se jim říká HLA proteiny a vědělo se o nich, že jsou příčinou známých imunologických problémů při orgánových transplantacích. Před více než 40 lety se ukázalo, že na těchto povrchových molekulách jsou navázané krátké fragmenty proteinů, které v buňce buď vznikly, nebo jí byly pohlceny.
Regulace všch funkcí
Pokud je buňka zdravá, nacházejí se na jejím povrchu desetitisíce exemplářů MHC proteinů vystavujících „normální“ fragmenty, kterých si imunitní zabijáci nevšímají (byli k tomu vychováni v průběhu svého vývoje v brzlíku). Pokud je ale infikovaná, na jejím povrchu se objeví též komplexy obsahující fragmenty pocházející z proteinů parazita, zabijácké T-lymfocyty je rozpoznají a na infikovanou buňku zaútočí.
Pro správné fungování imunitního systému jsou nepostradalelné také cytokiny, malé proteiny, které mnoha způsoby regulují prakticky všechny imunitní funkce |
Potíží je, že mnoho virově infikovaných (a také nádorových) buněk umí potlačit produkci MHC proteinů, a tím se stát neviditelnými pro zabijácké T-lymfocyty. Naštěstí i zde našla evoluce řešení – náš imunitní systém obsahuje také NK („natural killer“) lymfocyty, které vyhledávají a likvidují buňky, jež mají na povrchu abnormálně málo MHC proteinů. Pro správné fungování imunitního systému jsou nepostradalelné také cytokiny, malé proteiny, které mnoha způsoby regulují prakticky všechny imunitní funkce.
Ty začaly být objevovány před 40 lety a dnes je jich známo asi sto padesát. Některé – interferony – brání šíření virových infekcí v organismu tím, že v buňkách ohrožených virovou infekcí navozují „antivirový stav“, jiné – interleukiny – stimulují, nebo naopak tlumí aktivity imunitních buněk, vyvolávají, či tlumí zánětlivé reakce, další jsou nezbytné pro normální vývoj různých typů imunitních buněk z buněk kmenových.
Nejúspěšnější medicínský postup
Princip očkování (vakcinace) je známý nejméně od konce 18. století, kdy tento postup zavedl anglický lékař Edward Jenner. Ten využil zkušenosti venkovských dojiček, že ten, kdo prodělá relativně mírné onemocnění kravskými neštovicemi, je imunní proti nákaze pravými neštovicemi.
Vakcinace se stala zřejmě nejúspěšnějším medicínským postupem, který zachránil životy stamilionů lidí. Obrovským úspěchem bylo úplné vymýcení pravých neštovic koncem sedmdesátých let 20. století; o něco později byl tak vymýcen i dobytčí mor. |
Vakcinace se stala zřejmě nejúspěšnějším medicínským postupem, který zachránil životy stamilionů lidí. Obrovským úspěchem bylo úplné vymýcení pravých neštovic koncem sedmdesátých let 20. století; o něco později byl tak vymýcen i dobytčí mor.Počátkem 20. století se začalo rychle rozvíjet profylaktické očkování (aktivní imunizace) i terapeutické využití zvířecích (ovčích, koňských) protilátek (pasivní imunizace) zaměřených především proti bakteriálním a jiným toxinům získaným imunizací zvířat (ovcí, koz, koní, králíků).
V té době to byl průlom podobný jako o 50 let později objev antibiotik. Další kvalitativní skok v diagnostickém a terapeutickém využití moderních imunologických poznatků nastal koncem 20. století a je spojen zejména s objevem laboratorních metod přípravy monoklonálních protilátek.
Není bez zajímavosti, že když Georg Köhler a Cézar Milstein objevili na Cambridgeské univerzitě v sedmdesátých letech metodu přípravy těchto úžasných nástrojů, patentové oddělení univerzity nedoporučilo vyhazovat peníze za patentové poplatky za takový „nepraktický“ vynález. Dnes představuje globální trh s produkty založenými na monoklonálních protilátkách několik stovek miliard dolarů ročně a neustále roste…
Nežádoucí vedlejší účinky
Pro správné fungování imunitního systému je mimořádně důležité, aby nebyl autoreaktivní – aby neútočil proti vlastním buňkám a molekulám organismu, ale pouze proti cizorodým a potenciálně nebezpečným. Tato tolerance imunitního systému vůči vlastním buňkám a molekulám je zajišťována dvěma způsoby.
Všechny imunitní reakce jsou doprovázeny nežádoucími vedlejšími účinky, které nás trochu poškozují, nebo alespoň obtěžují – například v místě intenzivní zánětlivé reakce na poranění odumírají více či méně i zdravé okolní buňky a někdy po vyhojení zůstane ošklivá jizva |
Za prvé, odstraněním (negativní selekcí během raných fází vývoje) imunitních buněk, jež by produkovaly autoreaktivní protilátky, a také obdobnou eliminací autoreaktivních T-lymfocytů. Za druhé, jelikož mechanismy negativní selekce nejsou dokonalé, hraje při udržování imunologické tolerance zásadní aktivní role ještě několik druhů tlumivých buněk, především regulační T-lymfocyty, které drží na uzdě ty autoreaktivní imunitní buňky, jež unikly smrti v průběhu procesu negativní selekce a jež také brzdí příliš intenzivní obranné reakce.
Všechny imunitní reakce jsou doprovázeny nežádoucími vedlejšími účinky, které nás trochu poškozují, nebo alespoň obtěžují – například v místě intenzivní zánětlivé reakce na poranění odumírají více či méně i zdravé okolní buňky a někdy po vyhojení zůstane ošklivá jizva. Tyto imunopatologické reakce jsou ale většinou relativně mírné a „daní“ za to, že se náš organismus vypořádá s nebezpečnou infekcí. Někdy ale jejich míra překročí únosnou míru a negativní vedlejší účinky převáží.
Typickým příkladem jsou některé hepatitidy (virové záněty jater), u kterých jsou projevy choroby způsobeny především masivním „dobře míněným“ útokem na infikované jaterní buňky. Přehnaná aktivace velkého počtu imunitních buněk může vést k těžkým šokovým stavům (septický šok, „otrava krve“), imunitní zbraně obrácené nedopatřením proti vlastním buňkám mohou způsobit těžká autoimunitní onemocnění, například autoimunitní diabetes, revmatoidní artritidu či roztroušenou sklerózu.
Častěji ženy než muži
Je paradoxní, že navzdory obrovskému pokroku základního imunologického výzkumu dodnes většinou nevíme, co jsou spouštěcí mechanismy těchto chorob, a proč se projevují jen u některých jedinců. V posledních letech ale začínáme být stále lépe schopní do těchto porouchaných imunitních mechanismů účinně terapeuticky zasáhnout a tyto choroby léčit.
Většina autoimunitních chorob postihuje mnohem častěji ženy než muže, přičemž intenzita projevů těchto chorob se většinou výrazně snižuje v průběhu těhotenství. To je nepochybně projevem hormonálních vlivů, a určitě to souvisí s dobře známou vyšší reaktivitou ženského imunitního systému při fyziologických obranných reakcích nebo při očkování. |
Je pozoruhodné, ževětšina autoimunitních chorob postihuje mnohem častěji ženy než muže (například v případě autoimunitního zánětu štítné žlázy je poměr devět ku jedné, u revmatoidní arthritidy nebo roztroušené sklerózy dvě ku jedné) a že intenzita projevů těchto chorob se většinou výrazně snižuje v průběhu těhotenství.
To je nepochybně projevem hormonálních vlivů, a určitě to souvisí s dobře známou vyšší reaktivitou ženského imunitního systému při fyziologických obranných reakcích nebo při očkování (která dává smysl, protože pro evoluční úspěch našeho druhu jsou nesporně ženy mnohem důležitější než muži).
Mimochodem, těhotenství je z imunologického hlediska mimořádně zajímavý stav analogický transplantaci cizorodého orgánu (plod v děloze je pro matčin imunitní systém geneticky z poloviny cizorodý, podobně jako třeba ledvina od geneticky odlišného dárce). Organismus matky jej navzdory tomu toleruje; podílí se na tom několik dnes dobře prozkoumaných mechanismů.
Nevysilování se
V posledních desetiletích bije do očí stále narůstající epidemie autoimunitních chorob a alergií v ekonomicky vyspělých zemích. Zdá se, že vysvětlení poskytuje hygienická hypotéza reflektující fakt, že lidé jsou zejména v nejútlejším věku mnohem méně vystaveni různé „špíně“.
Malé děti se snažíme vychovávat v čistém, hygienickém prostředí, v důsledku čehož se vyvíjející imunitní systém nedostává stejně jako v minulosti do kontaktu se silnými antigenními podněty, jako jsou střevní parazité, půdní mykobakterie a jiné environmentální mikroorganismy a jejich produkty stimulující imunitní mechanismy.
Imunitní systém by měl nejen tolerovat vlastní struktury, ale ani by se neměl zbytečně vysilovat reakcemi na látky sice cizorodé, ale v podstatě neškodné, ba někdy pro nás dokonce užitečné, například složky potravy nebo symbiotické mikroorganismy v našich střevech |
Zdá se tedy pravděpodobné, že zásadní změny v kvalitě a kvantitě imunitních stimulačních podnětů v raném dětství se doposud nejasným způsobem projeví v nastavení regulační rovnováhy vyzrávajícího imunitního systému tak, že snáze reaguje na různé alergeny tvorbou protilátek IgE, jako by to byly součásti nějakých parazitů.
Imunitní systém by měl nejen tolerovat vlastní struktury, ale ani by se neměl zbytečně vysilovat reakcemi na látky sice cizorodé, ale v podstatě neškodné, ba někdy pro nás dokonce užitečné, například složky potravy nebo symbiotické mikroorganismy v našich střevech. Měl by reagovat, pokud možno, pouze na látky potenciálně nebezpečné.
S touto „teorií nebezpečí“ přišla před více než 20 lety originální švýcarsko-americká badatelka Polly Matzingerová (proslula například tím, že spoluautorem jednoho jejího článku v prestižním vědeckém časopise byl Galadriel Mirkwood; později se ukázalo, že to byl její afghánský chrt). Její teorie byla nejprve tvrdě odmítána, zčásti i kvůli její poněkud kontroverzní a provokativní povaze, ale nyní je to již učebnicová pravda. Dnes jsou i dobře objasněny mechanismy, jak imunitní systém rozpozná, co je potenciálně nebezpečné.
Zvýšená náchylnost k infekcím
Imunitní systém dělá problémy, když své aktivity přehánějí, ale ještě horší je, když některá z imunitních zbraní nefunguje, jak by měla. Takové stavy se označují jako imunitní nedostatečnost, respektive imunodeficience. Jejich charakteristickým projevem je především zvýšená náchylnost k infekcím. Imunodeficience mohou být buď vrozené, tedy geneticky podmíněné, nebo (a mnohem častěji) získané v průběhu života působením některých vnějších faktorů.
Vrozené imunodeficience, kterých je více než dvě stě, postihují častěji slabší, tedy mužské pohlaví, protože geny kódující některé imunologicky důležité proteiny leží na „ženském“ chromozomu X. Pokud se takový defekt vyskytne na jednom ze dvou X chromosomů u dívky, většinou svůj úkol zvládne stejný gen na druhém X chromozomu. U chlapců taková pojistka na maličkém Y chromozomu není.
Imunitní systém dělá problémy, když své aktivity přehánějí, ale ještě horší je, když některá z imunitních zbraní nefunguje, jak by měla. Takové stavy se označují jako imunitní nedostatečnost, respektive imunodeficience. Jejich charakteristickým projevem je především zvýšená náchylnost k infekcím. |
Novorozenci postižení nejzávažnějšími vrozenými imunodeficiencemi bez léčby umírají obvykle do jednoho roku po narození, protože jim nefungují nejdůležitější imunitní zbraně – protilátky ani T-lymfocyty. Pokud jsou tyto vrozené poruchy včas diagnostikované, mohou tyto děti přežívat jen ve sterilních podmínkách a být léčeny poměrně riskantní transplantací kostní dřeně od zdravého dárce. Jinou možností je dosud ne zcela optimalizovaná genová terapie – vpravení příslušného funkčního genu do krvetvorných kmenových buněk.
Získané imunodeficience jsou mnohem častější než vrozené – způsobuje je například podvýživa, metabolické choroby (diabetes), alkoholismus, chronická expozice chemickým škodlivinám (organická rozpouštědla), chronický stres, ale i některé léky. Těžké imunodeficience vyvolávají také rozsáhlé popáleniny, těžká traumatická zranění nebo závažné operace. To je paradoxní, protože by se dalo očekávat, že v takových rizikových situacích by bylo třeba imunitu posílit.
Oslabení imunity je také průvodním jevem nebo následkem některých infekčních onemocnění – řada virů i bakterií je totiž schopná účinně otupit některé imunitní zbraně. Nejvýraznějším příkladem je virus HIV, který vyvolává syndrom získané imunodeficience (AIDS).
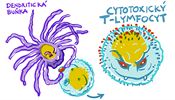
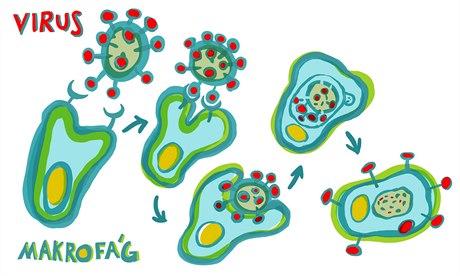
Imunitní systém: Dendritické buňky pohlcují a rozkládají cizorodé molekuly a mikroorganismy a některé fragmenty vystavují na povrchu (podobně jako makrofágy, ale mnohem efektivněji). Tam je rozpoznávají T- lymfocyty, které se tím aktivují a přeměňují se např. na cytotoxické T-lymfocyty schopné zabíjet infikované buňky. Jiné aktivované T-lymfocyty (tzv. pomocné) podporují přeměnu B-lymfocytů v plasmatické buňky nebo pomáhají vyvolávat zánět.
Převrat v léčbě
Imunitní systém se sice umí celkem dobře vypořádat s většinou infekčních onemocnění, ale v boji proti nádorovým onemocněním je mnohem slabší – nádorové buňky se totiž dokážou proti útokům imunitního systému účinně bránit. Navzdory tomu je dnes jasné, že imunitní systém je v principu schopný se vypořádávat i s nádorovými buňkami, ale potřebuje trochu pomoci.
Skutečný převrat v léčbě řady solidních nádorů přineslo v posledních letech použití „checkpoint inhibitorů“, monoklonálních protilátek blokujících nejdůležitější mechanismy, kterými se nádorové buňky aktivně brání útoku imunitního systému |
Dlouhou dobu byly tyto snahy málo úspěšné. Obrat nastal před několika lety a byl doslova dramatický – není přehnané mluvit o „imunoterapeutické revoluci“ založené zejména na použití monoklonálních protilátek. Skutečný převrat v léčbě řady solidních nádorů přineslo v posledních letech použití „checkpoint inhibitorů“, monoklonálních protilátek blokujících nejdůležitější mechanismy, kterými se nádorové buňky aktivně brání útoku imunitního systému.
Po jejich použití se zabijácké T-lymfocyty „odbrzdí“ a mohou plně uplatnit svůj vražedný potenciál. Tato terapie, odměněná loni i Nobelovou cenou, začala být úspěšně používaná u řady dosud neléčitelných nádorových onemocnění a její úspěšnost je podle typu nádoru 20 až 60 procent. Prozatím není jasné, proč tato (velmi nákladná) léčba zabírá jen u části pacientů.
Kontroverzní hypotézy
Průběh imunitních reakcí je více či méně ovlivněn i duševním rozpoložením, například chronickým stresem. Negativní vliv stresu na imunitní reakce zřejmě způsobují uvolňované „stresové hormony“ kortikosteroidy, které mají silné imunosupresivní účinky. Mechanismy vzájemného a oboustranně intenzivního působení buněk imunitního a nervového systému jsou dobře prozkoumány – existuje až překvapivě velký počet molekul sekretovaných buď neurony, nebo imunitními buňkami, které působí na oba tyto typy buněk.
Velice kontroverzní zatím zůstávají hypotézy, že intenzivní pozitivní emoce vyvolané například meditačními či mystickými praktikami nebo aktivní pozitivní „volní“ stimulace by mohly pozitivně ovlivňovat funkce imunitního systému. Spíše je to tak, že stavy pozitivních emocí potlačují imunosupresivní stres. |
Velice kontroverzní zatím zůstávají hypotézy, že intenzivní pozitivní emoce vyvolané například meditačními či mystickými praktikami nebo aktivní pozitivní „volní“ stimulace by mohly pozitivně ovlivňovat funkce imunitního systému. Spíše je to tak, že stavy pozitivních emocí potlačují imunosupresivní stres.
V této souvislosti je mimořádně zajímavá experimentálně prokázaná možnost podvědomého „placebového“ ovlivnění imunopatologických reakcí včetně autoimunitních chorob. V jedné studii laboratorní potkani dostávali imunosupresivní látky spolu se sladidlem. Když byla po nějaké době imunosupresiva postupně vysazena, byly autoimunitní či alergické reakce, ale i odhojování transplantátů významně potlačovány i samotným sladidlem.
Vznikl podmíněný reflex, v němž původní terapeutický účinek imunosupresivní látky převzaly imunitní regulační mechanismy evidentně prostřednictvím nervových drah. Je zřejmé, že podobné mechanismy se uplatňují i při některých klinických imunoterapeutických postupech – dominantně u nevědeckých, jako je homeopatie.
Psychiatrické choroby
Imunitní systém může „nechtěně“ přispívat ke vzniku řady neurologických a psychiatrických chorob. Nejde přitom jen o dobře známé autoimunitní choroby, jako je roztroušená skleróza, chorobná ospalost (narkolepsie), nebo myasthenia gravis.
Imunitní systém může „nechtěně“ přispívat ke vzniku řady neurologických a psychiatrických chorob. Nejde přitom jen o dobře známé autoimunitní choroby, jako je roztroušená skleróza, chorobná ospalost (narkolepsie), nebo myasthenia gravis. |
Ukazuje se, že řada molekul vyvolávajících obranné zánětlivé reakce – například cytokiny zvané IL-1, IL-6, IL-33 nebo některé bakteriální produkty stimulující imunitní odpovědi – a některé autoprotilátky pravděpodobně také přispívají ke vzniku těžké deprese a bipolární poruchy (manio-depresivního syndromu), a možná i schizofrenie. Terapeutické postupy zaměřené na snížení prozánětlivých aktivit těchto molekul by tedy mohly mít příznivý léčebný účinek.
Neurologická poškození se mohou objevit i v důsledku některých infekčních onemocnění (vzácně i po očkování proti nim), při kterých mohou vznikat protilátky, jež reagují „nedopatřením“ i s nervovými buňkami a následně je poškozují, například Guillainův-Barrého syndrom, který ročně postihuje několik jedinců na sto tisíc obyvatel a může vést k fatální paralýze.